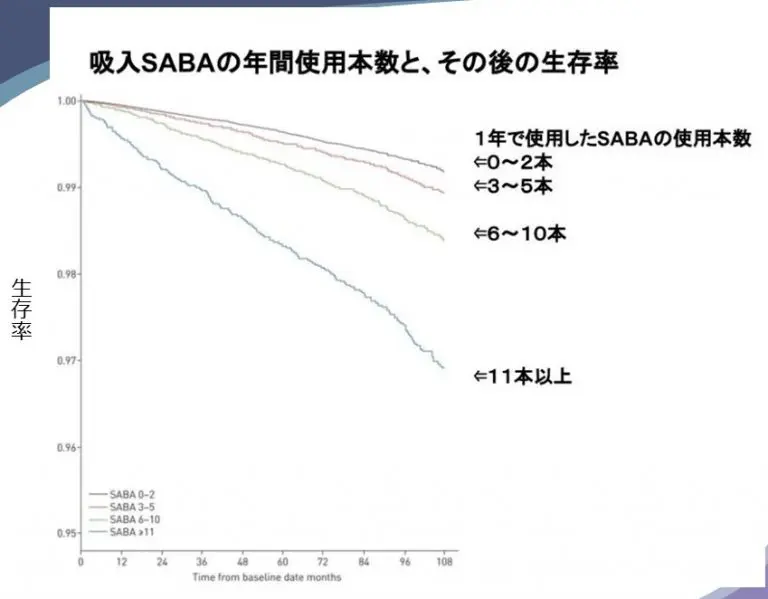
アテキュラ®とエナジア®という新薬がもうすぐ使用できるようになります。先週のブログでは、アテキュラ®が承認される元となった治験(PALLADIUM試験)を紹介しました。
コントロール不良喘息にはモメタゾン+インダカテロール(アテキュラ®)はモメタゾン(アズマネックス®)より有効、フルチカゾン+サルメテロール(アドエア®)とは同等の効果
本日はエナジア®が承認されることなった元の治験(IRIDIUM試験)についてお話します。
アテキュラ®が2剤の合剤であったのに対し、エナジア®は3剤の合剤であり、トリプル吸入薬になります。つまり、エナジア®を1回吸入すれば3種の薬を同時に吸入できます。合剤がなければ3つの吸入器をそれぞれ吸入しないといけないことを考えると、合剤を使うと患者さんの手間は3分の1になります。患者さんにとっては負担が減り、服薬遵守率の改善に伴い治療効果の向上が望めます。(どんなに良い薬でも、服薬しなければ治療効果はゼロだからです。)
現在、喘息およびCOPD(慢性閉塞性肺疾患)の長期管理に使用する吸入薬はその作用機序から、吸入ステロイド(ICS)、長時間作用型吸入β2刺激薬(LABA)、長時間作用型抗コリン薬(LAMA)の3種類に分類されます。
COPDの患者さんに対してはLAMAとLABAを中心に必要に応じてICSを追加するという治療方針をとります。一方、喘息の患者さんに対しては、ICSとLABAをまず使用して、コントロールできない場合にはLAMAを追加します。現在日本で喘息に使用できるICS+LABA合剤として、アドエア®、シムビコート®、フルティフォーム®、レルベア®の4種があります。この4種でコントロール不良の場合、追加できるLAMAはまだスピリーバ®のみです。そのため、3剤を吸入してもらっている患者さんは、異なる使用方法の吸入器2つで、毎日2回以上吸入しています。
例えば、シムビコート®とスピリーバ®を使用している患者さんは、シムビコート®は朝晩の1日2回、患者さんによって1回あたり1〜4吸入します。スピリーバ®は朝か晩の1日1回、1回あたり2吸入します。シムビコート®は粉末、スピリーバ®はエアゾールであり、吸入器の扱い方は全く異なります。患者さんにとっては、これをすべて覚えた上で、忘れずに毎日行うのはかなり大変だと思います。
2020年7月時点で販売されている3剤合剤の吸入薬にはテリルジー®とビレーズトリ®の2つがあります。いずれも保険適応病名はCOPDのみなので、喘息に使用することはできません。
過去のブログ記事参照
COPD に 対して3 剤同時吸入療法と 2 剤同時吸入療法では治療効果に差があるのか(IMPACT試験)
COPD(慢性閉塞性肺疾患)における3剤併用療法と2剤併用療法の治療効果は血中好酸球数で異なるのか:IMPACT試験の分析
中等症以上のCOPDには3剤合剤(トリプル)吸入療法が増悪予防に有効(ETHOS試験とIMPACT試験の比較)
日本でもトリプル吸入療法が喘息に使用できるようになるのは、喘息患者さんにとって朗報だと思います。今回紹介するエナジア®は近日中に使用できるようになりますし、まだ噂レベルですがテリルジー®も喘息に適応拡大されるみたいです。
PALLADIUM試験とIRIDIUM試験の最大の違いは、試験治療薬がPALLADIUMは2剤(アテキュラ®)に対し、IRIDIUMは3剤(エナジア®)になっているところです。対照薬が2剤(アドエア®)ですので、PALLADIUMは非劣性試験、IRIDIUMは優越性試験になります。(薬を3剤に増やすと、有害事象は必ず増えるので、治療効果が非劣性では意味がありません。)優越性を示すためには、2剤ではコントロールできず3剤でコントロールできるような患者を対象に選ばなければなりません。
患者登録基準をみてみると、PALLADIUM試験では%FEV1が50〜85%、中用量または高用量のICS療法または低用量ICS+LABA療法にもかかわらず喘息管理質問票7(ACQ7)のスコアが1.5以上、 喘息増悪の既往は不問とされています。一方のIRIDIUM試験では中用量または高用量のICS-LABAによる治療にもかかわらず、前年に少なくとも1回の喘息増悪があり、%FEV1が80%未満、症状を有する患者となっています。
実際に登録された患者の特徴をみてましょう。
このように、IRIDIUM試験に参加した患者は、PALLADIUM試験よりも重症の喘息であることがわかります。上記のような患者像に対しては、2剤より3剤の方が有効である(優越である)ことを証明しました。
下記のグラフは試験期間中のピークフロー改善量を各治療群毎にみています。
期間中を通じてピークフローは、高用量エナジア®は45ml程度、中用量エナジア®は40ml程度、高用量アテキュラ®は25-30ml、中用量アテキュラ®は20-25ml改善しています。
ピークフローが5ml増えても、患者さんの自覚症状はほとんど変わりないことが想定されます。つまり、例えば中用量アテキュラ®で治療中の患者さんの日々の症状を改善しようと思ったときは、高用量アテキュラ®に変更するより中用量エナジア®に変更するべきです。ICSの用量を増やしてPEFを5ml増やすよりも、LAMAを追加してPEFを20ml増やした方が症状の改善につながり、患者さんは喜ぶと思います。
逆に、患者さんの自覚症状改善よりも増悪発生を抑えたいときは、ICSを増やした方がよいことが予想されます。しかし、今回の1年という観察期間では増悪発生回数が少ないため、そこまでは読み取れるデータはありませんでした。
Once-daily, single-inhaler mometasone–indacaterol–glycopyrronium versus mometasone–indacaterol or twice-daily fluticasone–salmeterol in patients with inadequately controlled asthma (IRIDIUM): a randomised, double-blind, controlled phase 3 study
コントロール不良喘息の患者を対象とした、1日1回吸入のモメタゾン-インダカテロール-グリコピロニウム療法とモメタゾン-インダカテロール療法、または1日2回吸入のフルチカゾン-サルメテロール療法の比較:無作為化二重盲検第3相試験(IRIDIUM試験)

Published:July 09, 2020
DOI:https://doi.org/10.1016/S2213-2600(20)30190-9
概要
背景
吸入コルチコステロイドと長時間作用型β2アドレナリン受容体作動薬(ICS–LABA)の併用療法ではコントロールが不十分な喘息患者には、長時間作用型ムスカリン受容体拮抗薬を追加が有効である場合がある。 IRIDIUM試験の目的は、不適切にコントロールされた喘息患者において、ICS–LABAと比較して、フランカルボン酸モメタゾン、酢酸インダカテロール、臭化グリコピロニウム(MF–IND–GLY)の1日1回吸入療法の有効性と安全性を評価することあった 。
方法
52週間における二重盲検、二重ダミー、並行群、アクティブ制御の今回の第3相試験では、41か国の415施設から患者が募集された。中用量または高用量のICS-LABAによる治療にもかかわらず、前年に少なくとも1回の喘息増悪があり、%FEV1が80%未満、症状を有する18〜75歳の喘息患者が含まれた。登録患者は相互反応技術を用いて無作為に振り分けられ、中用量または高用量のMF-IND-GLY(80μg、150μg、50μg;160μg、150μg、 50μg)またはMF-IND(160μg、150μg;320μg、150μg)をBreezhalerで1日1回吸入、または高用量のフルチカゾン-サルメテロール(FLU-SAL; 500μg、50μg)をDiskusで1日2回吸入の5群に1:1:1:1:1で割り当てられた。主要な評価項目は、反復測定の混合モデルによって解析された完全解析セット(FAS)患者での、MF-IND-GLY群とMF-IND群における、治療26週目のトラフFEV1の治療前からの変化量の比較であった。安全性は、少なくとも1回量の治験薬を投与されたすべての患者で評価された。この試験はClinicalTrials.gov, NCT02571777に登録され、完了している。
調査結果
2015年12月8日から2019年6月14日までの間に、スクリーニングを受けた4851人の患者のうち3092人がランダムに割り当てられた(中用量MF–IND–GLY、n = 620;高用量MF–IND–GLY、n = 619;中用量MF-IND、n = 617;高用量MF-IND、n = 618;高用量FLU-SAL、n = 618)。 2747人(88.8%)の患者が52週間の治療を完了し、321人(10.4%)が試験治療を開始したが早期中止した。 中用量MF–IND–GLY(治療差[Δ] 76 mL [95%CI 41–111]; p <0.001)および高用量MF–IND–GLY(Δ65 mL [31–99]; p <0.001)は、MF-INDの対応する用量と比較して、26週目トラフFEV1の優れた改善を示した。26週目トラフFEV1の改善量は、高用量FLU–SALと比較して、中用量MF-IND-GLY(99 mL [64–133]); p < 0.001)および高用量MF–IND–GLY(119 mL [85–154]; p <0.001)の両群において大きかった。全患者において、有害事象の発生率は治療群間でバランスが取れていた。 研究期間中に7例の死亡が報告された(中用量MF-IND-GLYが1名、高用量MF-IND-GLYが2名、高用量MF-INDが4名)。 これらの死亡例のいずれにおいても、治験薬またはその他の治験関連要因が死因とは担当医は考えていなかった。
解釈
ICS-LABA併用(MF-INDおよびFLU-SAL)と比較して、MF-IND-GLYの1日1回1回1吸入により、喘息のコントロールが不十分な患者の肺機能が改善された。 安全性プロファイルは治療群間で類似していた。 したがって、MF-IND-GLY療法は、これらの患者にとって優れた治療選択肢となる。
資金提供
ノバルティス製薬
文責:院長 石本 修 (呼吸器専門医)